Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
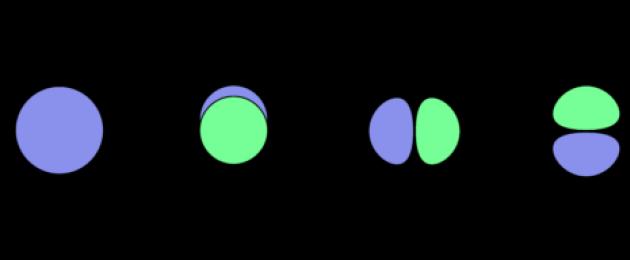
ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
- Одинарная связь – всегда является ϭ-связью
- Двойная связь всегда состоит из одной ϭ- и одной π-связи
- Тройная связь всегда образована одной ϭ- и двумя π-связями.
Укажем данные типы связей в молекуле пропиновой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
Так, например, при смешении одной s- и трех p- орбиталей образуются четыре sp 3 -гибридных орбитали:

В случае атомов углерода в гибридизации всегда принимает участие s- орбиталь, а количество p -орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p- орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
В зависимости от того, со скольким числом других атомов связан какой-либо атом углерода, он находится либо в состоянии sp 3 , либо в состоянии sp 2 , либо в состоянии sp- гибридизации:
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
Первый атом углерода связан с двумя другими атомами (1H и 1C), значит он находится в состоянии sp -гибридизации.
- Второй атом углерода связан с двумя атомами – sp -гибридизация
- Третий атом углерода связан с четырьмя другими атомами (два С и два Н) – sp 3 -гибридизация
- Четвертый атом углерода связан с тремя другими атомами (2О и 1С) – sp 2 -гибридизация.
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил .
Функциональная группа - структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.

R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
Продолжение. Начало см. в № 15, 16/2004
Урок 5. Гибридизация
атомных орбиталей углерода
Ковалентная химическая связь образуется при помощи общих связывающих электронных пар по типу:

Образовывать химическую связь, т.е. создавать
общую электронную пару с «чужим» электроном от
другого атома, могут только неспаренные
электроны. Неспаренные электроны при записи
электронных формул находятся по одному в
клетке-орбитали.
Атомная орбиталь
– это функция, которая
описывает плотность электронного облака в
каждой точке пространства вокруг ядра атома.
Электронное облако – это область пространства, в
которой с высокой вероятностью может быть
обнаружен электрон.
Для согласования электронного строения атома
углерода и валентности этого элемента
пользуются представлениями о возбуждении атома
углерода. В нормальном (невозбужденном)
состоянии атом углерода имеет два неспаренных 2р
2 -электрона.
В возбужденном состоянии (при поглощении
энергии) один из 2s
2 -электронов может
переходить на свободную р
-орбиталь. Тогда в
атоме углерода появляется четыре неспаренных
электрона:
Напомним, что в электронной формуле атома (например, для углерода 6 С – 1s 2 2s 2 2p 2) большие цифры перед буквами – 1, 2 – обозначают номер энергетического уровня. Буквы s и р указывают форму электронного облака (орбитали), а цифры справа над буквами говорят о числе электронов на данной орбитали. Все s -орбитали сферические:

На втором энергетическом уровне кроме 2s -орбитали имеются три 2р -орбитали. Эти 2р -орбитали имеют эллипсоидную форму, похожую на гантели, и ориентированы в пространстве под углом 90° друг к другу. 2р -Орбитали обозначают 2р х , 2р y и 2р z в соответствии с осями, вдоль которых эти орбитали расположены.
При образовании химических связей электронные орбитали приобретают одинаковую форму. Так, в предельных углеводородах смешиваются одна s -орбиталь и три р -орбитали атома углерода с образованием четырех одинаковых (гибридных) sр 3 -орбиталей:
![]()
Это – sр
3 -гибридизация.
Гибридизация
– выравнивание
(смешивание) атомных орбиталей (s
и р
) с
образованием новых атомных орбиталей,
называемых гибридными орбиталями
.
Гибридные орбитали имеют
асимметричную форму, вытянутую в сторону
присоединяемого атома. Электронные облака
взаимно отталкиваются и располагаются в
пространстве максимально далеко друг от друга.
При этом оси четырех sр
3-гибридных орбиталей
оказываются направленными к вершинам тетраэдра
(правильной треугольной пирамиды).
Соответственно углы между этими орбиталями –
тетраэдрические, равные 109°28".
Вершины электронных орбиталей могут
перекрываться с орбиталями других атомов. Если
электронные облака перекрываются по линии,
соединяющий центры атомов, то такую ковалентную
связь называют сигма()-связью
. Например, в молекуле этана
С 2 Н 6 химическая связь образуется
между двумя атомами углерода перекрыванием двух
гибридных орбиталей. Это -связь. Кроме того, каждый из
атомов углерода своими тремя sр
3 -орбиталями
перекрывается с s
-орбиталями трех атомов
водорода, образуя три -связи.
Всего для атома углерода возможны три
валентных состояния с различным типом
гибридизации. Кроме sр
3 -гибридизации
существует sр
2 - и sр
-гибридизация.
sр
2 -Гибридизация
– смешивание одной
s
- и двух р
-орбиталей. В результате
образуются три гибридные sр
2 -орбитали.
Эти sр
2 -орбитали расположены в одной
плоскости (с осями х
, у
) и направлены к
вершинам треугольника с углом между орбиталями
120°. Негибридизованная
р
-орбиталь перпендикулярна к плоскости трех
гибридных sр
2 -орбиталей (ориентирована
вдоль оси z
). Верхняя половина р
-орбитали
находится над плоскостью, нижняя половина – под
плоскостью.
Тип sр
2 -гибридизации углерода бывает у
соединений с двойной связью: С=С, С=О, С=N. Причем
только одна из связей между двумя атомами
(например, С=С) может быть -связью. (Другие связывающие
орбитали атома направлены в противоположные
стороны.) Вторая связь образуется в результате
перекрывания негибридных р
-орбиталей по обе
стороны от линии, соединяющей ядра атомов.
Ковалентная связь, образующаяся путем бокового перекрывания р -орбиталей соседних углеродных атомов, называется пи()-связью .
Образование
|
Из-за меньшего перекрывании орбиталей -связь менее
прочная, чем -связь.
sр
-Гибридизация
– это смешивание
(выравнивание по форме и энергии) одной s-
и
одной
р
-орбиталей с образованием двух гибридных sр
-орбиталей.
sр
-Орбитали расположены на одной линии (под
углом 180°) и направлены в противоположные стороны
от ядра атома углерода. Две
р
-орбитали остаются негибридизованными. Они
размещены взаимно перпендикулярно
направлениям -связей. На рисунке sр
-орбитали
показаны вдоль оси y
, а негибридизованные две
р
-орбитали– вдоль осей х
и z
.
Тройная углерод-углеродная связь СС состоит из -связи, возникающей
при перекрывании
sp
-гибридных орбиталей, и двух -связей.
Взаимосвязь таких параметров атома углерода, как
число присоединенных групп, тип гибридизации и
типы образуемых химических связей, показана в
таблице 4.
Таблица 4
Ковалентные связи углерода
| Число групп, связанных с углеродом |
Тип гибридизации |
Типы участвующих химических связей |
Примеры формул соединений |
|---|---|---|---|
| 4 | sp 3 | Четыре - связи | |
| 3 | sp 2 | Три - связи и одна - связь |
|
| 2 | sp | Две - связи и две -связи |
H–CC–H |
Упражнения .
1. Какие электроны атомов (например, углерода или азота) называют неспаренными?
2. Что означает понятие «общие электронные пары» в соединениях с ковалентной связью (например, СН 4 или Н 2 S)?
3. Какие электронные состояния атомов (например, С или N) называют основными, а какие возбужденными?
4. Что означают цифры и буквы в электронной формуле атома (например, С или N)?
5. Что такое атомная орбиталь? Сколько орбиталей на втором энергетическом уровне атома С и чем они различаются?
6. В чем отличие гибридных орбиталей от исходных орбиталей, из которых они образовались?
7. Какие типы гибридизации известны для атома углерода и в чем они заключаются?
8. Нарисуйте картинку пространственного расположения орбиталей для одного из электронных состояний атома углерода.
9. Какие химические связи называют и какие ? Укажите - и -связи в соединениях:
10. Для атомов углерода приведенных ниже соединений укажите: а) тип гибридизации; б) типы его химических связей; в) валентные углы.

Ответы на упражнения к теме 1
Урок 5
1. Электроны, которые находятся по одному на орбитали, называют неспаренными электронами . Например, в электронографической формуле возбужденного атома углерода – четыре неспаренных электрона, а у атома азота – три:
2. Два электрона, участвующие в образовании одной химической связи, называют общей электронной парой . Обычно до образования химической связи один из электронов этой пары принадлежал одному атому, а другой электрон – другому атому:

3. Электронное состояние атома, в котором соблюдается порядок заполнения электронных орбиталей: 1s 2 , 2s 2 , 2p 2 , 3s 2 , 3p 2 , 4s 2 , 3d 2 , 4p 2 и т.д., называют основным состоянием . В возбужденном состоянии один из валентных электронов атома занимает свободную орбиталь с более высокой энергией, такой переход сопровождается разъединением спаренных электронов. Схематически это записывают так:
Тогда как в основном состоянии было только два валентных неспаренных электрона, то в возбужденном состоянии таких электронов становится четыре.
5.
Атомная орбиталь – это функция,
которая описывает плотность электронного облака
в каждой точке пространства вокруг ядра данного
атома. На втором энергетическом уровне атома
углерода четыре орбитали – 2s
, 2р x
, 2р y
,
2р z
. Эти орбитали различаются:
а) формой электронного облака (s
– шар, р
–
гантель);
б) р
-орбитали имеют разную ориентацию в
пространстве – вдоль взаимно перпендикулярных
осей x
, y
и z
, их обозначают р x
, р y
,
р z
.
6.
Гибридные орбитали отличаются от
исходных (негибридных) орбиталей формой и
энергией. Например, s
-орбиталь – форма сферы, р
– симметричная восьмерка, sp
-гибридная
орбиталь – асимметричная восьмерка.
Различия по энергии: E
(s
) < E
(sр
) < E
(р
).
Таким образом, sp
-орбиталь – усредненная по
форме и энергии орбиталь, полученная смешиванием
исходных s
-
и p
-орбиталей.
7. Для атома углерода известны три типа гибридизации: sp 3 , sp 2 и sp (см. текст урока 5 ).
9.
-связь
– ковалентная связь, образующаяся путем
лобового перекрывания орбиталей по линии,
соединяющей центры атомов.
-связь –
ковалентная связь, образующаяся путем бокового
перекрывания р
-орбиталей по обе стороны от
линии, соединяющей центры атомов.
-Связи
показывают второй и третьей черточкой между
соединенными атомами.
В основном состоянии атом углерода С (1s 2 2s 2 2p 2) имеет два неспаренных электрона, за счет которых могут образовывать только две общие электронные пары. Однако в большинстве своих соединений углерод четырехвалентен. Это объясняется тем, что атом углерода, поглощая небольшое количество энергии, переходит в возбужденное состояние, в котором он имеет 4 неспаренных электрона, т.е. способен образовывать четыре ковалентные связи и принимать участие в формировании четырех общих электронных пар:
6 С 1 s 2 2s 2 2 p 2 6 С * 1 s 2 2s 1 2 p 3
| ↓ | |||||||||||||
| 1 | ↓ | p | ↓ | p | |||||||||
| s | s | ||||||||||||
Энергия возбуждения компенсируется образованием химических связей, которое происходит с выделением энергии.
Атомы углерода обладают способностью к образованию трех видов гибридизации электронных орбиталей (sp 3 , sp 2 , sp ) и образованию между собой кратных (двойных и тройных) связей (табл.7).
Таблица 7
Типы гибридизации и геометрия молекул
Простая (одинарная) s - связь осуществляется при sp 3 -гибридизации, при которой все четыре гибридных орбитали равноценны и имеют направленность в пространстве под углом 109 о 29 ’ друг к другу и ориентированы к вершинам правильного тетраэдра.
Рис. 19. Образование молекулы метана СН 4
Если гибридные орбитали углерода перекрываются с шарообразными s -орбиталями атома водорода, то образуется простейшее органическое соединение метан СН 4 – предельный углеводород (рис. 19).
Рис. 20. Тетраэдрическое расположение связей в молекуле метана
Большой интерес представляет изучение связей атомов углерода между собой и с атомами других элементов. Рассмотрим строение молекул этана, этилена и ацетилена.
Углы между всеми связями в молекуле этана почти точно равны между собой (рис. 21) и не отличаются от углов С-Н в молекуле метана.
Рис. 21. Молекула этана С 2 Н 6
Следовательно, атомы углерода находятся в состоянии sp 3 -гибридизации.
Гибридизация электронных орбиталей атомов углерода может быть и неполной, т.е. в ней могут участвовать две (sp 2 –гибридизация) или одна (sp -гибридизация) из трех р - орбиталей. В этом случае между атомами углерода образуются кратные (двойная или тройная) связи . Углеводороды с кратными связями называются непредельными или ненасыщенными. Двойная связь (С = С) образуется при sp 2 – гибридизации. В этом случае у каждого из атомов углерода одна из трех р - орбиталей не участвует в гибридизации, в результате образуются три sp 2 – гибридные орбитали, расположенные в одной плоскости под углом 120 о друг к другу, а негибридная 2р -орбиталь располагается перпендикулярно этой плоскости. Два атома углерода соединяются между собой, образуя одну s-связь за счет перекрывания гибридных орбиталей и одну p-связь за счет перекрывания р -орбиталей. Взаимодействие свободных гибридных орбиталей углерода с 1s-орбиталями атомов водорода приводит к образованию молекулы этилена С 2 Н 4 (рис. 22), - простейшего представителя непредельных углеводородов.
Рис. 22. Образование молекулы этилена С 2 Н 4
Перекрывание электронных орбиталей в случае p - связи меньше и зоны с повышенной электронной плотностью лежат дальше от ядер атомов, поэтому эта связь менее прочная, чем s - связь.
Тройная связь образуется за счет одной s - связи и двух p - связей. Электронные орбитали при этом находятся в состоянии sp-гибридизации, образование которой происходит за счет одной s - и одной р - орбиталей (рис. 23).
Рис. 23. Образование молекулы ацетилена С 2 Н 2
Две гибридные орбитали располагаются под углом 180 о относительно друг друга, а оставшиеся негибридные две р -орбитали располагаются в двух взаимно перпендикулярных плоскостях. Образование тройной связи имеет место в молекуле ацетилена С 2 Н 2 .
Особый вид связи возникает при образовании молекулы бензола (С 6 Н 6) – простейшего представителя ароматических углеводородов.
Бензол содержит шесть атомов углерода, связанных между собой в цикл (бензольное кольцо), при этом каждый атом углерода находится в состоянии sp 2 -гибридизации (рис. 24).
Все атомы углерода, входящие в молекулу бензола расположены в одной плоскости. У каждого атома углерода в состоянии sp 2 -гибридизации имеется еще одна негибридная р-орбиталь с неспаренным электроном, которая образует p - связь (рис. 25).
Ось такой р - орбитали расположена перпендикулярно плоскости молекулы бензола.
Рис. 24. sp 2 – орбитали молекулы бензола С 6 Н 6
Рис. 25. - связи в молекуле бензола С 6 Н 6
Все шесть негибридных р-орбиталей образуют общую связывающую молекулярную p - орбиталь, а все шесть электронов объединяются в p - электронный секстет.
Граничная поверхность такой орбитали расположена над и под плоскостью углеродного s - скелета. В результате кругового перекрывания возникает единая делокализованная p - система, охватывающая все углеродные атомы цикла. Бензол схематически изображают в виде шестиугольника с кольцом внутри, которое указывает на то, что имеет место делокализация электронов и соответствующих связей.
В основном состоянии атом углерода С (1s 2 2s 2 2p 2) имеет два неспаренных электрона, за счет которых могут образовать только две общие электронные пары. Однако в большинстве своих соединений углерод четырехвалентен. Это объясняется тем, что атом углерода, поглощая небольшое количество энергии, переходит в возбужденное состояние, в котором он имеет 4 неспаренных электрона, т.е. способен образовывать четыре ковалентные связи и принимать участие в формировании четырех общих электронных пар:
6 С 1s 2 2s 2 2p 2 6 С * 1s 2 2s 1 2p 3 .
| ↓ | ||||||||||||
| 1 | ↓ | p | ↓ | p | ||||||||
| s | s | |||||||||||
Энергия возбуждения компенсируется образованием химических связей, которое происходит с выделением энергии.
Атомы углерода обладают способностью к образованию трех видов гибридизации электронных орбиталей (sp 3 , sp 2 , sp ) и образованию между собой кратных (двойных и тройных) связей (табл. 2.2).
Таблица 2.2
Типы гибридизации и геометрия молекул
Простая (одинарная) s- связь осуществляется при sp 3 -гибридизации, при которой все четыре гибридных орбитали равноценны и имеют направленность в пространстве под углом 109°29 ’ друг к другу и ориентированы к вершинам правильного тетраэдра (рис. 2.8).

Рис. 2.8. Образование молекулы метана СН 4
Если гибридные орбитали углерода перекрываются с шарообразными s -орбиталями атома водорода, то образуется простейшее органическое соединение метан СН 4 − предельный углеводород.
Большой интерес представляет изучение связей атомов углерода между собой и с атомами других элементов. Рассмотрим строение молекул этана, этилена и ацетилена.
Углы между всеми связями в молекуле этана почти точно равны между собой (рис. 2.9) и не отличаются от углов С − Н в молекуле метана.
Следовательно, атомы углерода находятся в состоянии sp 3 -гибридизации.

Рис. 2.9. Молекула этана С 2 Н 6
Гибридизация электронных орбиталей атомов углерода может быть и неполной, т.е. в ней могут участвовать две (sp 2 -гибридизация) или одна (sp -гибридизация) из трех р -орбиталей. В этом случае между атомами углерода образуются кратныесвязи (двойная или тройная). Углеводороды с кратными связями называются непредельными или ненасыщенными. Двойная связь (С=С) образуется при sp 2 -гибридизации.
В этом случае у каждого из атомов углерода одна из трех р -орбиталей не участвует в гибридизации, в результате образуются три sp 2 -гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу, а негибридная 2р -орбиталь располагается перпендикулярно этой плоскости. Два атома углерода соединяются между собой, образуя одну s-связь за счет перекрывания гибридных орбиталей и одну p-связь за счет перекрывания р -орбиталей.
Взаимодействие свободных гибридных орбиталей углерода с 1s -орбиталями атомов водорода приводит к образованию молекулы этилена С 2 Н 4 (рис. 2.10) – простейшего представителя непредельных углеводородов.

Рис. 2.10. Образование молекулы этилена С 2 Н 4
Перекрывание электронных орбиталей в случае p-связи меньше и зоны с повышенной электронной плотностью лежат дальше от ядер атомов, поэтому эта связь менее прочная, чем s-связь.
Тройная связь образуется за счет одной s-связи и двух p-связей. Электронные орбитали при этом находятся в состоянии sp-гибридизации, образование которой происходит за счет одной s - и одной р -орбиталей (рис. 2.11).
Две гибридные орбитали располагаются под углом 180° относительно друг друга, а оставшиеся негибридные две р -орбитали располагаются в двух взаимно перпендикулярных плоскостях. Образование тройной связи имеет место в молекуле ацетилена С 2 Н 2 (см. рис. 2.11).

Рис. 2.11. Образование молекулы ацетилена С 2 Н 2
Особый вид связи возникает при образовании молекулы бензола (С 6 Н 6) – простейшего представителя ароматических углеводородов.
Бензол содержит шесть атомов углерода, связанных между собой в цикл (бензольное кольцо), при этом каждый атом углерода находится в состоянии sp 2 -гибридизации (рис. 2.12).

Рис. 2.12. sp 2 – орбитали молекулы бензола С 6 Н 6
Все атомы углерода, входящие в молекулу бензола расположены в одной плоскости. У каждого атома углерода в состоянии sp 2 -гибридизации имеется еще одна негибридная р-орбиталь с неспаренным электроном, которая образует p-связь (рис. 2.13).
Ось такой р -орбитали расположена перпендикулярно плоскости молекулы бензола.
Все шесть негибридных р -орбиталей образуют общую связывающую молекулярную p-орбиталь, а все шесть электронов объединяются в p-электронный секстет.
Граничная поверхность такой орбитали расположена над и под плоскостью углеродного s-скелета. В результате кругового перекрывания возникает единая делокализованная p-система, охватывающая все углеродные атомы цикла (рис. 2.13).
Бензол схематически изображают в виде шестиугольника с кольцом внутри, которое указывает на то, что имеет место делокализация электронов и соответствующих связей.

Рис. 2.13. -связи в молекуле бензола С 6 Н 6
Ионная химическая связь
Ионная связь − химическая связь, образованная в результате взаимного электростатического притяжения противоположно заряженных ионов, при котором устойчивое состояние достигается путем полного перехода общей электронной плотности к атому более электроотрицательного элемента.
Чисто ионная связь есть предельный случай ковалентной связи.
На практике полный переход электронов от одного атома к другому атому по связи не реализуется, поскольку каждый элемент имеет большую или меньшую (но не нулевую) ЭО, и любая химическая связь будет в некоторой степени ковалентной.
Такая связь возникает в случае большой разности ЭО атомов, например, между катионами s -металлов первой и второй групп периодической системы и анионами неметаллов VIА и VIIА групп (LiF, NaCl, CsF и др.).
В отличие от ковалентной связи, ионная связь не обладает направленностью . Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т.е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами независимо от направления.
Взаимодействие двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Следовательно, в отличие от ковалентной связи, ионная связь характеризуется также ненасыщаемостью .
Отсутствие у ионной связи направленности и насыщаемости обуславливает склонность ионных молекул к ассоциации. Все ионные соединения в твердом состоянии имеют ионную кристаллическую решетку, в которой каждый ион окружен несколькими ионами противоположного знака. При этом все связи данного иона с соседними ионами равноценны.
Металлическая связь
Металлы характеризуются рядом особых свойств: электро- и теплопроводностью, характерным металлическим блеском, ковкостью, высокой пластичностью, большой прочностью. Эти специфические свойства металлов можно объяснить особым типом химической связи, получившей название металлической .
Металлическая связь – результат перекрывания делокализованных орбиталей атомов, сближающихся между собой в кристаллической решетке металла.
У большинства металлов на внешнем электронном уровне имеется значительное число вакантных орбиталей и малое число электронов.
Поэтому энергетически более выгодно, чтобы электроны не были локализованы, а принадлежали всему атому металла. В узлах решетки металла находятся положительно заряженные ионы, которые погружены в электронный «газ», распределенный по всему металлу:
Me ↔ Me n + + n .
Между положительно заряженными ионами металла (Me n +) и нелокализованными электронами (n ) существует электростатическое взаимодействие, обеспечивающее устойчивость вещества. Энергия этого взаимодействия является промежуточной между энергиями ковалентных и молекулярных кристаллов. Поэтому элементы с чисто металлической связью (s -, и p -элементы) характеризуются относительно высокими температурами плавления и твердостью.
Наличие электронов, которые свободно могут перемещаться по объему кристалла, и обеспечивают специфические свойства ме-
Водородная связь
Водородная связь – особый тип межмолекулярного взаимодействия. Атомы водорода, которые ковалентно связаны с атомом элемента, имеющего высокое значение электроотрицательности (чаще всего F, O, N, а также Cl, S и C), несут на себе относительно высокий эффективный заряд. Вследствие этого такие атомы водорода могут электростатически взаимодействовать с атомами указанных элементов.
Так, атом Н d + одной молекулы воды ориентируется и соответственно взаимодействует (что показано тремя точками) с атомом О d - другой молекулы воды:

Связи, образуемые атомом Н, находящимся между двумя атомами электроотрицательных элементов, называются водородными:
d- d+ d-
А − Н ××× В
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (150–400 кДж/моль), однако этой энергии достаточно, чтобы вызвать агрегацию молекул соответствующих соединений в жидком состоянии, например, в жидком фтороводороде НF (рис. 2.14). Для соединений фтора она достигает порядка 40 кДж/моль.

Рис. 2.14. Агрегация молекул НF за счет водородных связей
Длина водородной связи также меньше длины ковалентной связи. Так, в полимере (HF) n длина связи F−H=0,092 нм, а связи F∙∙∙H= 0,14 нм. У воды длина связи O−H=0,096 нм, а связи O∙∙∙H=0,177нм.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления.
Похожая информация.
Связи между атомами, изображаемые в структурных формулах в виде черточек или палочек (стерженьков), образуются при взаимодействии внешних (валентных) электронов 2-х атомов одной молекулы. По характеру этого взаимодействия различают два основных или крайних типа связей между атомами.
1-ый тип. Ионная, или электровалентная, или солевая связь наиболее ярко (в чистом виде) представлена в случае взаимодействия атома сильного металла (например, щелочного) и атома сильного неметалла (например, галогена). Атом щелочного металла, теряя единственный внешний электрон, становится положительно заряженной частицей, а атом галогена, приобретая один внешний электрон, заряжается отрицательно: Na + - CI - . Прочность этой связи обусловлена кулоновскими силами притяжения между разнозаряженными частицами и энергией, выделяемой при образовании новой электронной пары у атома галогена. Примерами являются соли органических и неорганических кислот.
2-ой крайний тип. Более характерная для органических соединений ковалентная (или атомная) связь ярко (в чистом виде) представлена в 2-х атомных молекулах газов: Н 2 , O 2 , N 2 , С1 2 и др. в которых связь образована между совершенно одинаковыми атомами. В результате спаривания двух с противоположными спинами электронов двух атомов при их приближении друг к другу выделяется определенное количество энергии (≈ 400 кдж/моль) и новая электронная пара приобретает молекулярную орбиту, занимая в обоих атомах по одной ячейке. Причем наибольшая плотность электронного облака этой пары находится между атомами (происходит как бы перекрывание атомных орбит обоих электронов, рис. а) или образование молекулярной орбиты – рис б).

Хотя изображение б) более близко к истине, правомерны и применяются оба изображения ковалентной связи. В чисто ковалентной связи не происходит никакого отклонения центров положительных и отрицательных зарядов молекулы, они совпадают - молекула неполярна.
Кроме этих 2-х крайних типов связей (ионная и ковалентная) существуют промежуточные типы: 3) полярная, 4) полуполярная, 5) координационная, встречающаяся в основном в так называемых ониевых соединениях (оксониевых, аммониевых, сульфониевых).
В полярной связи электронная пара, находящаяся одновременно в поле центров обоих атомов (их ядер), отклонена в сторону более электроотрицательного атома, как например, в молекуле НС1 электронная пара больше находится в ячейке хлора, чем водорода:
Из-за этого отклонения электронной плотности произошло расхождение центров положительных и отрицательных зарядов молекулы. Она стала полярной, обладающей дипольным моментом (т.е. произведением заряда на половину расстояния между зарядами), неравным нулю.
Полуполярная связь наиболее ярко представлена в кислородных соединениях пятивалентного азота:
Изображение а) хотя допускается, но неправомочно, ибо у атома азота имеется только два электронных уровня (слоя), где на внешнем (2-ом) -слое имеется только четыре ячейки ипять пар электронов (пяти связей) не найдут там места. В связи с этим более верно изображение б), где показан резонанс крайних структур (I и III) и переход к более энергетически выгодной средней структуре. Таким образом, из-за симметричного распределения электронной плотности отрицательный заряд делится на половину между двумя равноценными атомами кислорода. Но в атоме азота на самом деле нет целого положительного заряда, а есть положительный заряд, близкий целому, соответственно, на атомах кислорода (структура П) имеются отрицательные заряды, близкие половине целого заряда.
Координационная связь наиболее устойчива в соединениях аммония, где атом азота становится четырехвалентным, отдавая протону (а в водной среде катиону гидроксония) один электрон, приобретая положительный заряд (или, другими словами, присоединяя протон к неподеленной паре электронов азота): Н 3 N: + Н + → Н 4 N +
аммиак протон катион аммония
В катионе аммония, образовавшаяся новая связь, видоизменяет природу ранее имевшихся у азота трех других связей N - Н, которые теперь становятся более вытянутыми, и все четыре атома водорода аммония, взаимно отталкиваясь, становятся в самые отдаленные друг от друга положения, а именно по углам правильного тетраэдра при нахождении атома азота в центре этого тетраэдра:

Образовавшаяся новая связь (координационная), ничем не отличается от видоизменившихся связей N - Н, ранее имевшихся в молекуле аммиака. Здесь имеет место s 1 р 3 - гибридизация четырех оставшихся у азота электронов (как у углерода метана).
Если молекула метана сравнительно прочное образование, не имеющее заряда, то катион аммония (отличающееся от него по строению лишь тем, что ядро центрального атома содержит на один протон и один нейтрон больше) менее устойчив и может легко диссоциировать на аммиак и катион гидроксония, преодолевая определенный энергетический барьер, обуславливающий прочность аммонийных соединений.
Понятие о σ -(сигма) и π- (пи) связях
Ковалентные связи, преобладающие в органических соединениях, в целом определяют химическую активность этих веществ. Однако большое значение имеют непрочные кратные связи (двойные, тройные) и особенности связей в функциональных группах.
Углерод - центральный элемент органического мира, углеродные скелеты (остовы молекул) определяют их устойчивость и практически безграничное их многообразие. Следует потому несколько подробнее рассмотреть электронную природу его связей.
Атом углерода имеет ядро с зарядом +6, и электронную оболочку: 1s 2 , 2s 2 , 2р 2 , где валентными являются четыре внешних электрона (2s 2 , 2р 2). Но, чтобы эти электроны могли образовать четыре связи, 2s 2 -электроны, находящиеся в объеме шара в спаренном виде, должны перейти в неспаренное состояние. И возбужденный атом углерода должен иметь оболочку: 1s 2 , 2s 1 , 2р 3 , где наряду с неспаренным s-электроном (формы шара) имеется три р-электрона (формы объемных восьмерок или гантелей), расположенные по осям координат (х, у, z) трехмерного пространства (рис. 3). Однако, чтобы образоватьчетыре равноценных между собой связи, как в метане, один s-электрон и три р-электрона должны перейти в видоизмененное гибридизированное (s 1 р 3 -гибридизация) состояние, причем все четыре внешних электрона уже имеют совершенно одинаковые направленные (гибридные) формы облаков, а атомы водорода метана находятся на равных, наиболее отдаленных друг от друга положениях:

которые соответствуют вершинам правильного тетраэдра, если в центре его поместить атом углерода метана (рис. 4). Состояние углерода, когда имеет место гибридизация валентных электронов в соотношении s 1 р 3 , и называется первым валентным состоянием углерода,
а связи такого атома с другими атомами называют б(сигма)-связями
(рис. 5, 6). 
Таким образом, σ-связь - это любая одинарная связь углерода с другим атомом. И наиболее распространенные в молекулах органических веществ C-H и C-H σ-связь имеют следующие основные данные (рис. 6б, 6в).
С-Н энергия связи ~93-96 ккал/моль (~370-380 кдж/моль).
Длина связи 1,1 А 0 (0,11 нм)
С-С энергия связи ~84-86 ккал/моль (~340-360 кдж/моль)
Длина связи 1,54 А 0 (0,154 нм)
Второе валентное состояние углерода характерно для этилена и других соединений с двойной связью. У углерода этилена имеет место гибридизация валентных электронов возбужденного атома (2s 1 , 2р 3) в соотношении s 1 p 2 , когда один р-электрон (из трех) не участвует в гибридизации и остается в р-форме. И гибридные облака направленной (вытянутой) формы располагаются в плоскости под углом друг к другу 120° (рис. 7).

А р-электроны двух углеродов спариваются в р-форме дополнительно к σ-связи между этими углеродами (рис. 7). Вот эта дополнительная (кратная) связь, образованная спариванием электронов в р-форме, и называется π (пи) - связью. Энергия, выделяемая при ее образовании, меньше энергии σ-связи, ибо энергия С = С двойной связи составляет ~140 ккал/моль (~560-580 кдж/моль). Если отсюда отнять энергию С - С σ-связи (~85 ккал/моль), то на π -связь остается ~55 ккал/моль (140-85=55).
Третье валентное состояние углерода характерно для ацетилена и других соединений с тройной связью. У углерода ацетилена из четырех валентных электронов (2s 1 , 2р 3) возбужденного атома в гибридизации участвуют по одному s- и р-электрону (s 1 p 1 - гибридизация). И гибридные (вытянутые) два облака располагаются на одной прямой, образуя σ-связи (рис. 8). То есть они занимают наиболее отдаленные положения (z-координату) уже от 2-х оставшихся в р-форме электронов, находящихся по осям координат (х,у) трехмерного пространства, спарившихся в р-форме с образованием двух π -связей во взаимно перпендикулярных плоскостях (рис. 8). Энергия, выделяемая при образовании тройной связи, составляет ~200 ккал/моль. Если отсюда отнять 85 ккал/моль - энергию σ-связи, то на две π-связи остается ~115 ккал/м, т.е. по ~57 ккал/моль на каждую π-связь. Приводим основные характеристики одинарной, двойной и тройной связей для сравнения:
С - С длина связи 1,54 А 0 , энергия образования связи ~85 ккал/моль
С = С длина связи 1,34 А 0 , энергия образования связи ~140 ккал/моль
С ≡ С длина связи 1,21 А 0 , энергия образования связи ~200 ккал/моль Электроны π-связей более объемны, слабее связаны с ядрами атомов, более доступны атаке реагента, легко подвергаются действию электрических и магнитных полей, например, падающего света или атаке заряженных частиц. Поэтому π -связи, обладая совершенно иной природой по сравнению с σ-связями, менее устойчивы и обуславливают высокую химическую активность непредельных соединений по сравнению с предельными (насыщенными) соединениями.