Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.
Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора. Кроме того, схема двух гальванических элементов предполагает наличие Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.

Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде - восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
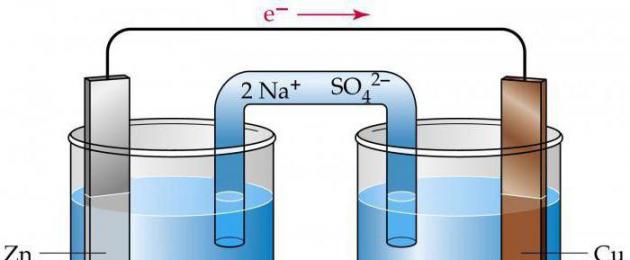
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.

Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.

Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Заключение
Принцип работы любого гальванического элемента основывается на окислительно-восстановительных процессах, протекающих на катоде и аноде. В зависимости от используемого металла, выбранного раствора электролита, меняется срок службы элемента, а также величина номинального напряжения. В настоящее время востребованы литиевые, кадмиевые гальванические элементы, имеющие достаточно продолжительный срок своей службы.
Химические источники электрического тока или гальванические элементы преобразуют энергию, выделяющуюся при протекании окислительно-восстановительных реакций, в электрическую энергию. Гальванические элементы служат источниками постоянного тока. Они подразделяются на химические и концентрационные .
Простейший химический гальванический элемент можно составить из двух металлических электродов, имеющих различные электродные потенциалы и соединенных в замкнутую цепь.
На электроде, который имеет меньшее значение электродного потенциала, будет происходить процесс окисления. Такой электрод называется иначе анодом .
На электроде, который имеет большее значение электродного потенциала, будет происходить процесс восстановления. Такой электрод называется иначе катодом .
Рассмотрим более подробно принцип работы гальванических элементов на примере элемента, составленного из цинкового и медного электродов. Такой элемент называется иначе элементом Якоби-Даниэля (рис. 94).
Рис. 94. Схема медно-цинкового гальванического элемента
Каждый электрод состоит из металлической пластинки, опущенной в раствор соли: ZnSO 4 и CuSO 4 , соответственно.
Растворы солей отделены друг от друга пористой перегородкой, сквозь которую легко могут проходить ионы металлов и SO 4 2- . Часто вместо пористой перегородки используют «солевой мостик » – стеклянную изогнутую трубку, заполненную насыщенным раствором KCl (рис. 95). В этом случае электроды не контактируют друг с другом, каждый из них находиться в отдельном сосуде, которые соединяются с помощью солевого мостика.
Рис. 95. Схема медноцинкового элемента с солевым мостиком: 1 – цинковая пластинка; 2 – медная пластинка; 3 – солевой мостик
При этом на цинковом электроде происходит процесс окисления:
Zn 0 – 2ē = Zn 2+ ,
в результате которого ионы цинка с пластинки переходят в раствор. Избыточные электроны по металлическому проводнику с цинковой пластинки переходят на медную и восстанавливают содержащиеся в растворе ионы Cu 2+
Cu 2+ + 2ē = Cu 0 ,
которые в виде нейтральных атомов оседают на пластинке. Остающиеся свободные сульфат-ионы медного электрода и появившиеся в избытке ионы Zn 2+ цинкового электрода через пористую перегородку или солевой мостик перемещаются навстречу друг другу. Таким образом, в цепи осуществляется перенос электрических зарядов и возникает электрический ток.
В этом элементе электрическая энергия получается в результате протекания химической реакции
Zn + CuSO 4 = Cu + ZnSO 4
Основной характеристикой гальванического элемента является электродвижущая сила (э.д.с.) , от которой зависит сила тока в цепи. Она равна разности электродных потенциалов
э.д.с. = Е 2 – Е 1
где Е 1 и Е 2 – соответственно, потенциал анода и катода.
Для гальванического элемента Якоби-Даниэля электродвижущая сила равна
э.д.с. = Е Cu – E Zn
Чем выше значение э.д.с. элемента, тем больше сила тока в его цепи.
Согласно уравнению Нернста потенциал медного и цинкового электродов рассчитывается по формулам:
E Cu = E Cu 0 +
E Zn = E Zn 0 +
Вычитая второе уравнение из первого получим выражение для расчета э.д.с. медно-цинкового гальванического элемента
э.д.с. = E Cu 0 – E Zn 0 + =
E Cu 0 – E Zn 0 +
Для любого другого элемента, составленного из двух металлических электродов, и в основе работы которого лежит химическая реакция, электродвижущая сила может быть вычислена по формуле:
э.д.с. = E 2 0 – E 1 0 +
где Е 2 0 и Е 1 0 – стандартные электродные потенциалы, соответственно, катода и анода; n 2 и n 1 – величины зарядов ионов, участвующих в полуреакциях, которые протекают на катоде и аноде; а 2 и а 1 – активности ионов металла в растворах у катода и анода, соответственно).
Для температуры 298K, при подстановке значений констант R и F и при переходе от натурального логарифма к десятичному наше уравнение запишется иначе:
э.д.с. = E 2 0 – E 1 0 + 0,059
Гальванические элементы можно обозначать в виде схемы. Слева обычно приводится электрод или полуэлемент с меньшим значением электродного потенциала (анод), а справа – с большим значением электродного потенциала (катод).
При записи электродов сперва указывают твердую фазу (например, металл в случае металлического или редокс-электрода), а затем – вещества, растворенные в жидкой фазе. Фазы отделяются друг от друга одной вертикальной чертой. Если в одной фазе содержится несколько компонентов, то они записываются через запятую.
Границу раздела между растворами двух электродов изображают пунктирной вертикальной чертой или двумя сплошными линиями ½½ (если растворы отделяются друг от друга солевым мостиком).
В соответствии с вышеизложенными правилами схема элемента Якоби-Даниэля выглядит следующим образом:
Zn ½ ZnSO 4 ½½ CuSO 4 ½ Cu
Гальванический элемент может быть составлен и из двух редокс-электродов, имеющих разное значение редокс-потенциала. Такие элементы называются иначе окислительно-восстановительными гальваническими элементами. Они тоже относятся к химическим гальваническим элементам, т.к. в основе их действия лежит протекание химической реакции.
Гальванический элемент, в котором источником энергии является не химическая реакция, а работа выравнивания концентраций (активностей) ионов, называется концентрационным. Он может состоять из двух одинаковых металлических электродов, погруженных в растворы одной и той же соли, но с различной концентрацией (активностью) ионов металла (рис. 96), например:
Zn ½ ZnSO 4 ½½ ZnSO 4 ½ Zn или Ag ½ AgNO 3 ½½ AgNO 3 ½ Ag
Рис. 96. Цинковая концентрационная цепь: М – солевой мостик, содержащий хлорид калия
Электрод, находящийся в более разбавленном растворе, растворяется, его ионы переходят в раствор:
Cu – 2ē ® Cu 2+
Ag – ē ® Ag +
Сам электрод при этом заряжается отрицательно.
На электроде, погруженном в более концентрированный раствор, наоборот, осаждаются ионы металла, и он заряжается положительно. Таким образом, на обоих электродах протекают процессы, приводящие к выравниванию концентрации ионов металла в растворах.
Потенциалы электродов при этом равны:
E 1 = E 0 + ; E 2 = E 0 +
Вычитая первое уравнение из второго получим формулу для подсчета э.д.с. с концентрационного элемента:
э.д.с. = E 2 – E 1 =
Концентрационный элемент будет работать до тех пор пока активности ионов металлов в обоих растворах не сравняются; при а 1 = а 2 его э.д.с. будет равна 0.
Кроме электролиза, возможен еще один вариант протекания окислительно- восстановительной реакции. В этом случае электроны от восстановителя к окислителю переходят по металлическому проводнику через внешнюю электрическую цепь. В результате во внешней цепи возникает электрический ток, и такое устройство называют гальваническим элементом.
Гальванические элементы являются химическими источниками тока
- устройствами для прямого преобразования химической энергии в электрическую, минуя другие ее формы.
Гальванические элементы на основе различных металлов и их соединений нашли широкое практическое применение как химические источники тока.
В гальваническом элементе химическая энергия преобразуется в электрическую. Простейший гальванический элемент представляет собой два сосуда с растворами CuSO 4 и ZnSO 4 , в которые погружены соответственно медная и цинковая пластинки. Сосуды соединены между собой трубкой, которая называется солевым мостиком, заполненной раствором электролита (например, KCl). Такая система называется медно-цинковым гальваническим элементом.
Схематически процессы, протекающие в медно-цинковом гальваническом элементе или же, другими словами, схема гальванического элемента, представлена на рисунке ниже.
 Схема гальванического элемента
Схема гальванического элемента
На аноде протекает процесс окисления цинка:
Zn — 2е – = Zn 2+ .
В результате этого атомы цинка превращаются в ионы, которые переходят в раствор, а цинковый анод растворяется, и его масса уменьшается. Обратите внимание, что анод в гальваническом элементе является отрицательным электродом (за счет электронов, полученных от атомов цинка) в отличие от процесса электролиза, где он подключается к положительном полюсу внешней батареи.
Электроны от атомов цинка по внешней электрической цепи (металлическому проводнику) движутся к катоду, где протекает процесс восстановления ионов меди из раствора ее соли:
Cu 2+ + 2е – = Cu.
В результате этого образуются атомы меди, которые осаждаются на поверхности катода, и его масса увеличивается. Катодом в гальваническом элементе является положительно заряженный электрод.
Суммарное уравнение реакции, протекающей в медно-цинковом гальваническом элементе, можно представить так:
Zn + Cu 2+ = Zn 2+ + Cu.
Фактически протекает реакция замещения меди цинком в ее соли. Эту же реакцию можно осуществить и иным способом - погрузить цинковую пластинку в раствор CuSO 4 . При этом образуются те же самые продукты - медь и ионы цинка. Но отличие реакции в медно-цинковом гальваническом элементе в том, что процессы отдачи и присоединения электронов пространственно разделены. Процессы отдачи (окисление) и присоединения (восстановление) электронов происходят не при непосредственном контакте атома Zn с ионом Сu 2+ , а в разных местах системы - соответственно на аноде и на катоде, которые соединены металлическим проводником. При таком способе проведения этой реакции электроны перемещаются от анода к катоду по внешней цепи, представляющей собой металлический проводник. Направленный и упорядоченный поток заряженных частиц (в данном случае электронов) и есть электрический ток . Во внешней цепи гальванического элемента возникает электрический ток. Вам необходимо включить JavaScript, чтобы проголосовать
О.С.ЗАЙЦЕВ
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИКЗАДАЧНИКЛАБОРАТОРНЫЙ ПРАКТИКУМНАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5, 7, 11, 13, 14, 16, 17, 20, 22, 24, 29, 30, 31, 34/2004
§ 8.2. Реакции на границе металл–раствор
(продолжение)
Составим цепь из двух электродов, например,
медного и цинкового. Обсудим три варианта такого
гальванического элемента.
Сразу скажем, что первый вариант нам будет
неинтересен. Опустим цинковую и медную пластинки
в стакан с раствором их солей – сульфатов цинка и
меди (рис. 8.6). Соединим электроды проводниками
через прибор для измерения напряжения –
вольтметр, который на рисунке обозначен символом
«В».
И цинк, и медь посылают в раствор свои ионы, но равновесие соответствующих реакций смещено в сторону металлов, т. к. они находятся не в чистой воде, а в растворе, содержащем ионы этих металлов. Несмотря на это, цинк обладает более высокой способностью посылать в раствор ионы и иметь более высокое отрицательное значение электродного потенциала. Поэтому ионы меди устремятся к цинковому электроду, и на цинке образуется медь:
Zn + Cu 2+ = Zn 2+ + Cu.
Переход электронов происходит непосредственно
на поверхности цинка, разность потенциалов между
пластинками не возникает, и вольтметр не покажет
напряжения.
Изменим опыт. Поместим в сосуд перегородку из
пористой керамики (рис. 8.7).
Электроны покидают цинк и по
проводнику через вольтметр переходят на медь,
где взаимодействуют с ионами меди, в результате
чего медь осаждается на медном электроде.
Одновременно ионы цинка переходят в раствор.
Пористая перегородка служит для того, чтобы не
допустить подхода ионов меди к цинку и тем самым
предотвратить прямой переход электронов с цинка
на ионы меди вместо перехода по проводнику. По
мере прохождения реакции ионы цинка переходят от
цинка к меди, аналогичное происходит с ионами
меди.
Пористая перегородка плохо предотвращает
смешение растворов, и, кроме того, изготовление
сосудов с пористой перегородкой затруднительно,
поэтому можно поступить следующим образом.
Возьмем два стакана, нальем в них растворы,
которые соединим электролитическим мостиком –
П-образной стеклянной трубкой, заполненной
насыщенным раствором хлорида калия (рис. 8.8).
В концы трубок вставлены ватные тампоны, чтобы
жидкость из мостика не выливалась.
Итак, пористая перегородка заменена
электролитическим мостиком. В нем хлорид-ионы
двигаются к цинковому электроду, а ионы калия – к
медному электроду. Мостик разделяет электродные
пространства, предотвращает электропроводность
за счет перемещения ионов цинка и меди, понижает
потенциал, возникающий при контакте двух
различных растворов. Дополнительный потенциал
также возникает при движении ионов с различными
скоростями, а ионы калия и хлорид-ионы
передвигаются с почти одинаковыми скоростями.
Составим цепь (см. рис. 8.8) из стандартных медного
и цинкового электродов (концентрации ионов
металлов в растворах по 1 моль/л). Определим
направление реакции в этом гальваническом
элементе и его ЭДС:

Потенциал цинкового электрода имеет отрицательный знак, а медного – положительный. Следовательно, цинковый электрод обладает большей способностью отдавать электроны, и на нем будет проходить противоположно направленная реакция, а медный электрод будет электроны принимать:

Таким образом, если мы погрузим кусок
металлического цинка в раствор сульфата меди, то
цинк будет переходить в раствор в виде ионов и
одновременно на нем будет осаждаться слой меди.
В списке электродных потенциалов есть реакция:
2H + (10 –7 M, вода) + 2e = H 2 (г.), Е = –0,41 В.
Это потенциал водородного электрода в воде. Все
металлы, которые расположены в списке выше и
электродные потенциалы которых имеют более
высокие отрицательные значения, должны
реагировать с водой («растворяться») с
образованием водорода. Но вы прекрасно знаете,
что железо, хром, цинк, алюминий при обычных
условиях с водой не реагируют. Магний реагирует с
горячей водой, а натрий, кальций, калий и литий
реагируют с водой при обычных условиях. Это
объясняется тем, что на железе, хроме, цинке,
алюминии образуются малорастворимые оксидные
пленки, исключающие доступ воды к металлу. При
удалении слоя оксида начинается взаимодействие
этих металлов с водой. Оксиды или гидроксиды
натрия, кальция, калия, лития растворимы в воде и
не защищают металлы от контакта с водой.
Для электродных реакций, потенциалов и ЭДС
применимы все те формулы, которые мы раньше
вывели для окислительно-восстановительных
реакций:
G = –nЕF = Н – Т S = –RT ln K = –nЕ 96 484 = –2,303 8,314 Т lg К.
При вычислении константы равновесия помните, что кристаллические фазы (металлы) в выражение константы равновесия не записываются, т.к. концентрация кристаллического вещества не зависит от его количества, т.е. постоянна. Например:

Электродные потенциалы и ЭДС электрохимических реакций очень сильно зависят от концентраций ионов и рН среды. Поэтому часто предсказываемое для стандартных условий направление процесса не совпадает с тем, которое осуществляется при данных условиях.
О том, как определить направление реакции при нестандартных условиях, смотрите в учебниках химии для высшей школы.
Список новых и забытых понятий и слов
Примером химического гальванического элемента может служить элемент Якоби-Даниэля (рис. 6). Он состоит из медного электрода (медной пластинки, погруженной в раствор CuSO 4) и цинкового электрода (цинковой пластинки, погруженной в раствор ZnSO 4). На поверхности цинковой пластинки возникает ДЭС и устанавливается равновесие
Zn ⇄ Zn 2+ + 2ē
При этом возникает электродный потенциал цинка, и схема электрода будет иметь вид Zn|ZnSO 4 или Zn|Zn 2+ .
Аналогично, на медной пластинке также возникает ДЭС и устанавливается равновесие
Cu ⇄ Cu 2+ + 2ē
Поэтому возникает электродный потенциал меди, и схема электрода будет иметь вид Cu|CuSO 4 или Cu|Cu 2+ .
На Zn-электроде (электрохимически более активном), протекает процесс окисления: Zn – 2ē →Zn 2+ . На Cu-электроде (электрохимически менее активном) протекает процесс восстановления: Cu 2+ + 2ē → Cu.
Рис. 6 Схема медно-цинкового гальванического элемента
Суммарное уравнение электрохимической реакции:
Zn + Cu 2+ → Zn 2+ + Cu
или Zn + CuSO 4 → ZnSO 4 + Cu
Поскольку схема химического гальванического элемента записывается по правилу «правого плюса», то схема элемента Якоби–Даниэля будет иметь вид
Двойная черта в схеме обозначает электролитический контакт между электродами, осуществляемый обычно посредством солевого мостика.
В марганцево-цинковом гальваническом элементе (рис. 7) , как и в медно-цинковом, анодом служит цинковый электрод. Положительный электрод прессуется из смеси диоксида марганца с графитом и ацетиленовой сажей в виде столбика «агломерата», в середине которого помещается угольный стержень ‑ токоотвод.
Рис. 7 Схема сухого марганцево-цинкового элемента
1 – анод (цинковый стаканчик), 2 – катод (смесь диоксида марганца с графитом), 3 – токоотвод из графита с металлическим колпачком,
4 - электролит
Применяемый в марганцово-цинковых элементах электролит, содержащий хлорид аммония, вследствие гидролиза NH 4 CI имеет слабокислую реакцию. В кислом электролите на положительном электроде идет токообразующий процесс:
МnO 2 + 4Н + + 2ē → Мn 2+ + 2Н 2 O
В электролите с рН равным 7-8 ионов водорода слишком мало и реакция начинает протекать с участием воды:
МnО 2 + H 2 O + ē → MnOOH + ОН -
МnООН - это неполный гидроксид марганца (III) – манганит.
По мере расходования ионов водорода на токообразующий процесс электролит становится из кислого нейтральным или даже щелочным. Удержать кислую реакцию в солевом электролите при разряде элементов не удается. Добавить кислоту к солевому электролиту нельзя, так как это вызовет сильный саморазряд и коррозию цинкового электрода. По мере накопления на электроде манганита он частично может реагировать с ионами цинка, образующимися при разряде цинкового электрода. При этом получается труднорастворимое соединение ‑ гетаэролит, и раствор подкисляется:
2MnOOH + Zn 2+ → ZnO∙Мn 2 O 3 + 2Н +
Образование гетаэролита предохраняет электролит от слишком сильного подщелачивания при разряде элемента.