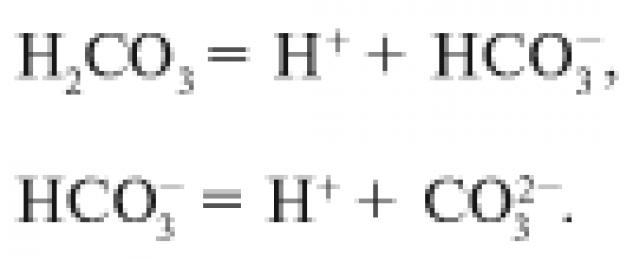, , 21 , , ,
, 25-26 , 27-28 ,
, 30, , , , , , , , /2003
§ 6.3. Сильные и слабые электролиты
Материал этого раздела частично вам знаком по ранее изученным школьным курсам химии и из предыдущего раздела. Кратко повторим, что вам известно, и познакомимся с новым материалом.
В предыдущем разделе мы обсуждали поведение в
водных растворах некоторых солей и органических
веществ, полностью распадающихся на ионы в
водном растворе.
Имеется ряд простых, но несомненных
доказательств того, что некоторые вещества в
водных растворах распадаются на частицы. Так,
водные растворы серной H 2 SO 4 , азотной HNO 3 ,
хлорной HClO 4 , хлороводородной (соляной) HCl,
уксусной CH 3 COOH и других кислот имеют кислый
вкус. В формулах кислот общей частицей является
атом водорода, и можно предположить, что он (в
виде иона) является причиной одинакового вкуса
всех этих столь различных веществ.
Образующиеся при диссоциации в водном растворе
ионы водорода придают раствору кислый вкус,
поэтому такие вещества и названы кислотами. В
природе только ионы водорода имеют кислый вкус.
Они создают в водном растворе так называемую
кислотную (кислую) среду.
Запомните, когда вы говорите «хлороводород», то имеете в виду газообразное и кристаллическое состояние этого вещества, но для водного раствора следует говорить «раствор хлороводорода», «хлороводородная кислота» или использовать общепринятое название «соляная кислота», хотя состав вещества в любом состоянии выражается одной и той же формулой – НСl.
Водные растворы гидроксидов лития (LiOH), натрия
(NаОН), калия (КОН), бария (Ва(ОН) 2), кальция
(Са(ОН) 2) и других металлов имеют одинаковый
неприятный горько-мыльный вкус и вызывают на
коже рук ощущение скольжения. По-видимому, за это
свойство ответственны гидроксид-ионы ОН – ,
входящие в состав таких соединений.
Хлороводородная HCl, бромоводородная HBr и
йодоводородная HI кислоты реагируют с цинком
одинаково, несмотря на свой различный состав, т.
к. в действительности с цинком реагирует не
кислота:
Zn + 2НСl = ZnСl 2 + Н2,
а ионы водорода:
Zn + 2H + = Zn 2+ + Н 2 ,
и образуются газообразный водород и ионы цинка.
Смешивание некоторых растворов солей, например
хлорида калия KCl и нитрата натрия NaNO 3 , не
сопровождается заметным тепловым эффектом, хотя
после выпаривания раствора образуется смесь
кристаллов четырех веществ: исходных – хлорида
калия и нитрата натрия – и новых – нитрата калия
КNO 3 и хлорида натрия NaCl. Можно предположить,
что в растворе две исходные соли полностью
распадаются на ионы, которые при его выпаривании
образуют четыре кристаллических вещества:
Сопоставляя эти сведения с
электропроводностью водных растворов кислот,
гидроксидов и солей и с рядом других положений,
С.А.Аррениус в 1887 г. выдвинул гипотезу
электролитической диссоциации, согласно которой
молекулы кислот, гидроксидов и солей при
растворении их в воде диссоциируют на ионы.
Изучение продуктов электролиза позволяет
приписать ионам положительные или отрицательные
заряды. Очевидно, если кислота, например азотная
НNO 3 , диссоциирует, предположим, на два иона
и при электролизе водного раствора на катоде
(отрицательно заряженный электрод) выделяется
водород, то, следовательно, в растворе имеются
положительно заряженные ионы водорода Н + .
Тогда уравнение диссоциации следует записать
так:
НNO 3 = Н + + .
Электролитическая диссоциация
–
полный или частичный распад соединения при его
растворении в воде на ионы в результате
взаимодействия с молекулой воды (или другого
растворителя).
Электролиты
– кислоты, основания или
соли, водные растворы которых проводят
электрический ток в результате диссоциации.
Вещества, не диссоциирующие в водном растворе на
ионы и растворы которых не проводят
электрический ток, называются неэлектролитами
.
Диссоциация электролитов количественно
характеризуется степенью диссоциации
– отношением числа распавшихся на ионы
«молекул» (формульных единиц) к общему числу
«молекул» растворенного вещества. Степень
диссоциации обозначается греческой буквой . Например, если из
каждых 100 «молекул» растворенного вещества 80
распадаются на ионы, то степень диссоциации
растворенного вещества равна: = 80/100 = 0,8, или 80%.
По способности к диссоциации (или, как говорят,
«по силе») электролиты разделяют на сильные
,
средние
и слабые
. По степени
диссоциации к сильным электролитам относят те из
них, для растворов которых > 30%, к слабым – < 3%, к средним – 3% 30%. Сила электролита –
величина, зависящая от концентрации вещества,
температуры, природы растворителя и др.
В случае водных растворов
к сильным электролитам
( > 30%) относят
перечисленные ниже группы соединений.
1
. Многие неорганические кислоты,
например хлороводородная НCl, азотная HNO 3 ,
серная H 2 SО 4 в разбавленных растворах.
Самая сильная неорганическая кислота – хлорная
НСlО 4 .
Сила некислородных кислот возрастает в ряду
однотипных соединений при переходе вниз по
подгруппе кислотообразующих элементов:
HCl – HBr – HI.
Фтороводородная (плавиковая) кислота HF растворяет стекло, но это вовсе не говорит о ее силе. Эта кислота из бескислородных галогенсодержащих относится к кислотам средней силы из-за высокой энергии связи Н–F, способности молекул HF к объединению (ассоциации) благодаря сильным водородным связям, взаимодействия ионов F – с молекулами НF (водородные связи) с образованием ионов и других более сложных частиц. В результате концентрация ионов водорода в водном растворе этой кислоты оказывается значительно пониженной, поэтому фтороводородную кислоту считают средней силы.
Фтороводород реагирует с диоксидом кремния, входящим в состав стекла, по уравнению:SiO 2 + 4HF = SiF 4 + 2H 2 O.
Фтороводородную кислоту нельзя хранить в стеклянных сосудах. Для этого используют сосуды из свинца, некоторых пластмасс и стекла, стенки которых покрыты изнутри толстым слоем парафина. Если для «травления» стекла использовать газообразный фтороводород, то поверхность стекла становится матовой, что используется для нанесения на стекло надписей и различных рисунков. «Травление» стекла водным раствором фтороводородной кислоты приводит к разъеданию поверхности стекла, которая остается прозрачной. В продаже обычно бывает 40%-й раствор плавиковой кислоты.
Сила однотипных кислородных кислот изменяется
в противоположном направлении, например йодная
кислота НIО 4 слабее хлорной кислоты НСlО 4 .
Если элемент образует несколько кислородных
кислот, то наибольшей силой обладает кислота, в
которой кислотообразующий элемент имеет самую
высокую валентность. Так, в ряду кислот НСlО
(хлорноватистая) – НСlО 2 (хлористая) – НСlО 3
(хлорноватая) – НСlО 4 (хлорная) последняя
наиболее сильная.
Один объем воды растворяет около двух объемов хлора. Хлор (примерно половина его) взаимодействует с водой:
Cl 2 + H 2 O = HCl + HСlO.
Хлороводородная кислота является сильной, в ее водном растворе практически нет молекул HCl. Правильнее уравнение реакции записать так:
Cl 2 + H 2 O = H + + Cl – + HClO – 25 кДж/моль.
Образующийся раствор называют хлорной водой.
Хлорноватистая кислота – быстродействующий окислитель, поэтому ее применяют для отбеливания тканей.
2 . Гидроксиды элементов главных подгрупп I и II групп периодической системы: LiОН, NaОН, КОН, Са(ОН) 2 и др. При переходе вниз по подгруппе по мере усиления металлических свойств элемента сила гидроксидов возрастает. Растворимые гидроксиды главной подгруппы I группы элементов относят к щелочам.
Щелочами называют растворимые в воде основания. К ним относят также гидроксиды элементов главной подгруппы II группы (щелочно-земельные металлы) и гидроксид аммония (водный раствор аммиака). Иногда щелочами считают те гидроксиды, которые в водном растворе создают высокую концентрацию гидроксид-ионов. В устаревшей литературе вы можете встретить в числе щелочей карбонаты калия К 2 СО 3 (поташ) и натрия Na 2 CO 3 (сода), гидрокарбонат натрия NaHCO 3 (питьевая сода), буру Na 2 B 4 O 7 , гидросульфиды натрия NaHS и калия KHS и др.
Гидроксид кальция Са(ОН) 2 как сильный электролит диссоциирует в одну ступень:
Са(ОН) 2 = Са 2+ + 2ОН – .
3 . Почти все соли. Соль, если это сильный электролит, диссоциирует в одну ступень, например хлорид железа:
FeCl 3 = Fe 3+ + 3Cl – .
В случае водных растворов к слабым электролитам ( < 3%) относят перечисленные ниже соединения.
1 . Вода H 2 O – важнейший электролит.
2
. Некоторые неорганические и почти
все органические кислоты: H 2 S
(сероводородная), H 2 SO 3 (сернистая), H 2 CO 3
(угольная), HCN (циановодородная), Н 3 РО 4
(фосфорная, ортофосфорная), H 2 SiO 3
(кремниевая), H 3 BO 3 (борная, ортоборная),
СН 3 СООН (уксусная) и др.
Заметим, что угольная кислота в формуле H 2 CO 3
не существует. При растворении углекислого газа
СО 2 в воде образуется его гидрат СО 2 Н 2 О,
который мы для удобства расчетов записываем
формулой H 2 CO 3 , и уравнение реакции
диссоциации выглядит так:

Диссоциация слабой угольной кислоты проходит в
две ступени. Образующийся гидрокарбонат-ион также ведет себя
как слабый электролит.
Точно так же ступенчато диссоциируют и другие
многоосновные кислоты: Н 3 РО 4
(фосфорная), H 2 SiO 3 (кремниевая), H 3 BO 3
(борная). В водном растворе диссоциация
практически проходит лишь по первой ступени. Как
осуществить диссоциацию по последней ступени?
3
. Гидроксиды многих элементов, например
Аl(OH) 3 , Cu(OH) 2 , Fe(OH) 2 , Fe(OH) 3 и др.
Все эти гидроксиды диссоциируют в водном
растворе ступенчато, например гидроксид железа
Fe(OH) 3:

В водном растворе диссоциация проходит
практически только по первой ступени. Как
сместить равновесие в сторону образования ионов
Fe 3+ ?
Осно"вные свойства гидроксидов одного и того же
элемента усиливаются с уменьшением валентности
элемента. Так, осно"вные свойства дигидроксида
железа Fe(OH) 2 выражены сильнее, чем у
тригидроксида Fe(OH) 3 . Это утверждение
равносильно тому, что кислотные свойства Fe(OH) 3
проявляются сильнее, чем у Fe(OH) 2 .
4
. Гидроксид аммония NH 4 OH.
При растворении газообразного аммиака NH 3 в
воде получается раствор, который очень слабо
проводит электрический ток и имеет
горько-мыльный вкус. Среда раствора осно"вная,
или щелочная. Объясняется такое поведение
аммиака следующим образом. При растворении
аммиака в воде образуется гидрат аммиака NH 3 Н 2 О,
которому условно мы приписываем формулу
несуществующего гидроксида аммония NH 4 OH,
считая, что это соединение диссоциирует с
образованием иона аммония и гидроксид-иона ОН – :
NH 4 OH = + ОН – .
5 . Некоторые соли: хлорид цинка ZnCl 2 , тиоцианат железа Fe(NСS) 3 , цианид ртути Hg(CN) 2 и др. Эти соли диссоциируют ступенчато.
К электролитам средней силы некоторые относят фосфорную кислоту Н 3 РО 4 . Мы будем считать фосфорную кислоту слабым электролитом и записывать три ступени ее диссоциации. Серная кислота в концентрированных растворах ведет себя как электролит средней силы, а в очень концентрированных растворах – как слабый электролит. Мы далее будем считать серную кислоту сильным электролитом и записывать уравнение ее диссоциации в одну ступень.
1. ЭЛЕКТРОЛИТЫ
1.1. Электролитическая диссоциация. Степень диссоциации. Сила электролитов
Согласно теории электролитической диссоциации, соли, кислоты, гидроксиды, растворяясь в воде, полностью или частично распадаются на самостоятельные частицы – ионы.
Процесс распада молекул веществ на ионы под действием полярных молекул растворителя называют электролитической диссоциацией . Вещества, диссоциирующие на ионы в растворах, называют электролитами. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называют катионами ; к ним относятся, например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами ; к ним принадлежат ионы кислотных остатков и гидроксид-ионы.
Для количественной характеристики процесса диссоциации введено понятие степени диссоциации. Степенью диссоциации электролита (α) называется отношение числа его молекул, распавшихся в данном растворе на ионы ( n ), к общему числу его молекул в растворе ( N ), или
α = .
Степень электролитической диссоциации принято выражать либо в долях единицы, либо в процентах.
Электролиты со степенью диссоциации больше 0,3 (30%) обычно называют сильными, со степенью диссоциации от 0,03 (3%) до 0,3 (30%)-средними, менее 0,03 (3%)-слабыми электролитами. Так, для 0,1 M раствора CH 3 COOH α = 0,013 (или 1,3 %). Следовательно, уксусная кислота является слабым электролитом. Степень диссоциации показывает, какая часть растворенных молекул вещества распалась на ионы. Степень электролитической диссоциации электролита в водных растворах зависит от природы электролита, его концентрации и температуры.
По своей природе электролиты можно условно разделить на две большие группы: сильные и слабые . Сильные электролиты диссоциируют практически полностью (α = 1).
К сильным электролитам относятся:
1) кислоты (H 2 SO 4 , HCl , HNO 3 , HBr , HI , HClO 4 , H М nO 4 );
2) основания – гидроксиды металлов первой группы главной подгруппы (щелочи) – LiOH , NaOH , KOH , RbOH , CsOH , а также гидроксиды щелочноземельных металлов – Ba (OH ) 2 , Ca (OH ) 2 , Sr (OH ) 2 ;.
3) соли, растворимые в воде (см. таблицу растворимости).
Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном в недиссоциированном состоянии (в молекулярной форме). Для слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами.
К слабым электролитам относятся:
1) неорганические кислоты ( H 2 CO 3 , H 2 S , HNO 2 , H 2 SO 3 , HCN , H 3 PO 4 , H 2 SiO 3 , HCNS , HСlO и др.);
2) вода (H 2 O );
3) гидроксид аммония ( NH 4 OH );
4) большинство органических кислот
(например, уксусная CH 3 COOH, муравьиная HCOOH);
5) нерастворимые и малорастворимые соли и гидроксиды некоторых металлов (см. таблицу растворимости).
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Например, диссоциация соляной кислоты (НС l ) записывается следующим образом:
HCl → H + + Cl – .
Основания диссоциируют с образованием катионов металла и гидроксид-ионов. Например, диссоциация КОН
КОН → К + + ОН – .
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато. Например,
H 2 CO 3 H + + HCO 3 – ,
HCO 3 – H + + CO 3 2– .
Первое равновесие – диссоциация по первой ступени – характеризуется константой
![]() .
.
Для диссоциации по второй ступени:
![]() .
.
В случае угольной кислоты константы диссоциации имеют следующие значения: K I = 4,3 × 10 –7 , K II = 5,6 × 10 –11 . Для ступенчатой диссоциации всегда K I >K II >K III > ... , т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы.
Средние (нормальные) соли, растворимые в воде, диссоциируют с образованием положительно заряженных ионов металла и отрицательно заряженных ионов кислотного остатка
Ca(NO 3) 2 → Ca 2+ + 2NO 3 –
Al 2 (SO 4) 3 → 2Al 3+ +3SO 4 2– .
Кислые соли (гидросоли) – электролиты, содержащие в анионе водород, способный отщепляться в виде иона водорода Н + . Кислые соли рассматривают как продукт, получающийся из многоосновных кислот, в которых не все атомы водорода замещены на металл. Диссоциация кислых солей происходит по ступеням, например:
KHCO 3 → K + + HCO 3 – (первая ступень)
Константа гидролиза равна отношению произведения концентраций
продуктов гидролиза к концентрации негидролизованной соли.
Пример 1. Вычислить степень гидролиза NH 4 Cl.
Решение: Из таблицы находим Кд(NH 4 ОН)=1,8∙10 -3 , отсюда
Кγ=Кв/Кд к = =10 -14 /1,8∙10 -3 = 5,56∙10 -10 .
Пример 2. Вычислить степень гидролиза ZnCl 2 по 1 ступени в 0,5 М растворе.
Решение: Ионное уравнение гидролиза Zn 2 + H 2 O ZnOH + + H +
Kд ZnOH +1=1,5∙10 -9 ; hγ=√(Кв/ [Кд осн ∙Cм]) = 10 -14 /1,5∙10 -9 ∙0,5=0,36∙10 -2 (0,36%).
Пример 3. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na 2 CO 3 ; в) ZnSO 4 . Определите реакцию среды растворов этих солей.
Решение: а) Цианид калия KCN - соль слабой одноосновной кислоты (см. табл. I приложения) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К + и анионы CN - . Катионы К + не могут связывать ионы ОН - воды, так как КОН - сильный электролит. Анионы же CN - связывают ионы Н + воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CN - + Н 2 О HCN + ОН -
или в молекулярной форме
KCN + Н 2 О HCN + КОН
В результате гидролиза в растворе появляется некоторый избыток ионов ОН - , поэтому раствор KCN имеет щелочную реакцию (рН > 7).
б) Карбонат натрия Na 2 CO 3 - соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО 3 2- , связывая водородные ионы воды, образуют анионы кислой соли НСО - 3 , а не молекулы Н 2 СО 3 , так как ионы НСО - 3 диссоциируют гораздо труднее, чем молекулы Н 2 СО 3 . В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CO 2- 3 +H 2 O HCO - 3 +ОН -
или в молекулярной форме
Na 2 CO 3 + Н 2 О NaHCO 3 + NaOH
В растворе появляется избыток ионов ОН - , поэтому раствор Na 2 CO 3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO 4 - соль слабого многокислотного основания Zn(OH) 2 и сильной кислоты H 2 SO 4 . В этом случае катионы Zn + связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH + . Образование молекул Zn(OH) 2 не происходит, так как ионы ZnOН + диссоциируют гораздо труднее, чем молекулы Zn(OH) 2 . В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn 2+ + Н 2 О ZnOН + + Н +
или в молекулярной форме
2ZnSO 4 + 2Н 2 О (ZnOH) 2 SO 4 + H 2 SO 4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO 4 имеет кислую реакцию (рН < 7).
Пример 4. Какие продукты образуются при смешивании растворов A1(NO 3) 3 и К 2 СО 3 ? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение. Соль A1(NO 3) 3 гидролизуется по катиону, а К 2 СО 3 - по аниону:
А1 3+ + Н 2 О А1ОН 2+ + Н +
СО 2- 3 + Н 2 О НСО - з + ОН -
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н + и ОН - образуют молекулу слабого электролита Н 2 О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН) 3 и СО 2 (Н 2 СО 3). Ионно-молекулярное уравнение:
2А1 3+ + ЗСО 2- 3 + ЗН 2 О = 2А1(ОН) 3 + ЗСО 2
молекулярное уравнение: ЗСО 2 + 6KNO 3
2A1(NO 3) 3 + ЗК 2 СО 3 + ЗН 2 О = 2А1(ОН) 3
Электрический ток – направленное движение заряженных частиц – электронов или ионов.
Электролиты – это вещества, растворы или расплавы (в ЕГЭ чаще речь о растворах) которых проводят электрический ток, то есть содержат заряженные частицы. Свободных электронов в растворе не бывает, носителями заряда являются ионы. Электрический ток проводят расплавы веществ с ионной кристаллической решеткой.
К электролитам относятся:
- Кислоты
- Основания
Чем больше в растворе заряженных частиц, тем лучше он проводит электрический ток, т.е. чем больше молекул вещества диссоциирует, тем более сильным электролитом оно является.
Список сильных и слабых электролитов нужно знать наизусть!
Сильные электролиты (в растворах): 11
- Растворимые соли
FeCl 3 , CuSO 4 , K 2 CO 3 и т.д.
- Щелочи
8 растворимых гидроксидов: LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH) 2 , Sr(OH) 2 , Ca(OH) 2 .
- Сильные кислоты
HI, HBr, HCl, H 2 SO 4(разб) , HNO 3 , HClO 4 , HClO 3 , HMnO 4 , H 2 CrO 4
Слабые электролиты:
- Слабые основания
нерастворимые гидроксиды, NH 3 ∙H 2 O, растворы аминов
- Слабые кислоты и кислоты средней силы
H 3 PO 4 , HF, H 2 SO 3 , H 2 CO 3 , H 2 S, H 2 SiO 3 , органические кислоты.
- Вода
H 2 O – очень слабый электролит, диссоциирует ничтожно мало. Чистая дистиллированная вода не проводит ток.
Неэлектролиты: большинство органических соединений, оксиды, вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи и т.д.
Сила электролита определяется степенью диссоциации. Рассмотрим соль А 2 В и кислоту Н 3 Х:
Диссоциация - всегда обратимый процесс.
Соли диссоциируют (обратимо распадаются на ионы) почти на 100%:
А 2 В ⇄ 2А + + В 2- . Так как все молекулы распались на ионы, из 1 моль АВ получилось 1 моль В 2- и 2 моль А + , то есть три моль ионов.
Многоосновные кислоты и основания диссоциируют ступенчато:
Н 3 Х ⇄ H + + H 2 X -
H 2 X - ⇄ HX 2- + H +
HX 2- ⇄X 3- + H +
При этом каждая следующая ступень диссоциации протекает хуже предыдущей, т.к. присутсвует конкурирующий процесс - обратная реакция. Порядок примерно такой: Из 1 моль молекул слабой кислоты по первой ступени диссоциировало 0,05 моль, по второй - 0,0002 моль и по третьей – 0,00000001 моль. Итого образовалось чуть больше 0,1 моль ионов.
Очевидно, этот раствор этой кислоты проводит ток хуже, чем раствор соли.
Пара вопросов для тренировки:
1) Какие частицы образутся при диссоциации нитрата натрия
а) Na + , N +5 , O -2 ; б) Na + , NO 3 - в) Na, NO 2 , O 2 г) NaNO 2 , O 2
Решение: нитрат натрия образован остатком азотной кислоты и катионом натрия. Уравнение его диссоциации: NaNO3 ⇄ Na + + NO 3 - . Ответ б).
2) В четырех пробирках находятся одномолярные растворы следующих веществ:
а) H 3 PO 4 б) Na 2 SO 4 в) NaCl г) HBr
В какой пробирке больше всего ионов?
Решение: a) ортофосфорная кислота – средней силы, диссоциирует слабо, большая часть молекул останутся в растворе молекулами.
б) сульфат натрия – соль, диссоциирует полностью, из одного моль соли олучается три моль ионов: Na 2 SO 4 ⇄ 2Na + + SO 4 2- .
в) хлорид натрия – соль, диссоциирует полностью, из одного моль соли образуется два моль ионов: NaCl ⇄ Na + + Cl - .
г) бромоводородная кислота – сильная, но диссоциирует не полностью (в отличие от солей). В реакции HBr ⇄ H+ + Br- из одного моль HBr образуется меньше двух моль ионов.