Значение кислорода для человека неоценимо велико. Он необходим для дыхания живых организмов, активно участвует в процессах горения. Получением кислорода занимаются растения. Именно в их зеленых листьях осуществляется важный процесс фотосинтеза, который и обогащает атмосферу земли этим ценным газом. А возможно ли получать кислород человеку? Промышленным способом его добывают из воздуха. При этом воздух сжижают и одновременно очищают. Но ведь на земной поверхности огромные запасы простого вещества воды, в химический состав которой входит кислород. Соответственно, еще один способ получения кислорода – это разложение воды. Причем осуществить данный процесс можно даже в домашних условиях.
Для этого понадобится гальваническая ванна, в которую наливается вода на высоту, превышающей середину ванны. В воду надо добавить до 2 мл разбавленной серной кислоты или едкого натра. Это делается для усиления электропроводности воды. Кроме того, необходимо взять два пластмассовых стакана. В дне каждого из них делается отверстие. Через него внутрь стакана помещается угольная пластина - электрод. Можно использовать и другой металл в качестве электрода (медный или железный) . А воздушную прослойку между такой пластиной и стаканом нужно хорошо заизолировать. Электроды помещаются в воду так, чтобы стаканы расположились вверх дном. А воздуха между дном стакана и поверхностью воды должно быть как можно меньше.
К верхней части каждого электрода припаивается металлический провод. Этими проводами электроды подключают к полюсам источника питания. Электрод, подключенный к отрицательному полюсу, называется катодом. А положительный электрод – анодом. В результате, при прохождении через воду электрического тока происходит электролиз воды. Химическая реакция идет по такому типу 2 H2O→2 H2+O2. Как видно из уравнения, образуется два газа. На катоде внутри стакана собирается водород, а на аноде – кислород. Образование газов можно наблюдать по поднимающимся из воды пузырьков. Образующийся кислород можно выводить из стакана в другой сосуд с помощью трубки от капельницы. Чтобы убедиться в наличии кислорода, можно внести в сосуд тлеющую лучину. Она ярко вспыхнет.
Любой химический опыт должен проводиться с соблюдением техники безопасности. Так и в этом случае нельзя смешивать эти два вида полученных газов. Также нужно избегать смешивания водорода с воздухом. Надо помнить, что водород взрывоопасен. Получение кислорода из воды приведенным способом дает небольшое количество данного газа. Образующийся кислород дополнительно вступает в реакцию с углем (материалом анода) с образованием примеси (углекислого газа) . Избежать этого можно, но надо использовать инертный электрод в виде металлической пластины, покрытой слоем платины или золота. . Такие устройства для получения кислорода называются электролизеры. Правда, количество получаемого кислорода невелико, и процесс требует больших затрат электроэнергии. Зато поиск исходного вещества (воды) не вызовет затруднений.
На сегодня вопрос экологии выходит на первый план. Но здоровая экология невозможна без кислорода. Именно он является основным кирпичиком поддержания жизни на планете . Кроме этого, кислород часто участвует во многих химических реакциях. Давайте рассмотрим, как получить кислород в условиях химической лаборатории.
Чтобы получить кислород укрепим пробирку из тугоплавкого стекла на штативе и внесем в нее 5 г порошкообразной (нитрата калия KNO 3 или нитрата натрия NaNO 3). Поставим под пробирку чашку из огнеупорного материала, наполненную песком, так как при этом опыте часто плавится и вытекает горячая масса. Поэтому и горелку при нагревании будем держать сбоку. Когда мы сильно нагреем селитру, она расплавится и из нее выделится кислород (обнаружим это с помощью тлеющей лучины – она воспламенится в пробирке). При этом нитрат калия перейдет в нитрит KNO 2 . Бросим затем тигельными щипцами или пинцетом кусок черенковой в расплав (никогда не держать лицо над пробиркой). Сера воспламенится и сгорит с выделением большого количества тепла. Опыт следует проводить при открытых окнах (из-за получающихся окислов серы).
Процесс протекает следующим образом (нагревание):
2KNO 3 → 2KNO 2 + О 2
Получить кислород можно и другими методами. Перманганат калия КМnО 4 отдает при нагревании кислород и превращается при этом в оксид марганца (4):
2КМnO 4 → МnO 2 + К 2 МnО 4 + O 2 .
Из 10 г перманганата калия можно получить примерно литр кислорода, значит двух граммов достаточно, чтобы наполнить кислородом пять пробирок нормальной величины.
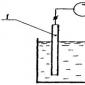
Некоторое количество перманганата калия нагреем в тугоплавкой пробирке и уловим в пробирки выделяющийся кислород с помощью пневматической ванны. Кристаллы, растрескиваясь, разрушаются, и, зачастую некоторое количество пылеобразного перманганата увлекается вместе с газом. Вода в пневматической ванне и отводной трубке в этом случае окрасится в красный .
В больших количествах получить кислород можно также из пероксида (перекиси) водорода Н 2 О 2 . Пероксид водорода мало устойчив. Уже при стоянии на воздухе он разлагается на кислород и :
2Н 2 O 2 → 2H 2 O + О 2
Получить кислород можно существенно быстрее, если добавить к пероксиду немного диоксида марганца МnО 2 , активного угля, металлического порошка, крови (свернувшейся или свежей), слюны. Эти вещества действуют как катализаторы .
Мы можем в этом убедиться, если в маленькую пробирку поместим примерно 1 мл пероксида водорода с одним из названных веществ, а наличие выделяющегося кислорода установим с помощью пробы лучинкой. Если в химическом стакане к 5 мл трехпроцентного раствора пероксида водорода добавить равное количество крови животного, то смесь сильно вспенится, пена застынет и вздуется в результате выделения пузырьков кислорода.
Катализаторы повышают скорость реакции химического процесса и при этом сами не расходуются. В конечном итоге они снижают энергию активации, необходимую для возбуждения реакции. Но существуют и вещества, действующие противоположным образом. Их называют отрицательными катализаторами или ингибиторами . Например, фосфорная кислота препятствует разложению пероксида водорода. Поэтому продажный раствор пероксида водорода обычно стабилизирован фосфорной или мочевой кислотой. В живой природе во многих процессах участвуют так называемые биокатализаторы (энзимы, гормоны).
При и резке металла осуществляется высокотемпературным газовым пламенем, получаемым при сжигании горючего газа или паров жидкости в смеси с технически чистым кислородом.
Кислород является самым распространенным элементом на земле , встречающимся в виде химических соединений с различными веществами: в земле - до 50% по массе, в соединении с водородом в воде - около 86% по массе и в воздухе - до 21% по объему и 23% по массе.
Кислород при нормальных условиях (температура 20°С, давление 0,1 МПа) - это бесцветный, негорючий газ, немного тяжелее воздуха, не имеющий запаха, но активно поддерживающий горение. При нормальном атмосферном давлении и температуре 0°С масса 1 м 3 кислорода равна 1,43 кг, а при температуре 20°С и нормальном атмосферном давлении - 1,33 кг.
Кислород имеет высокую химическую активность , образуя соединения со всеми химическими элементами, кроме (аргона, гелия, ксенона, криптона и неона). Реакции соединения с кислородом протекают с выделением большого количества теплоты, т. е. носят экзотермический характер.
При соприкосновении сжатого газообразного кислорода с органическими веществами, маслами, жирами, угольной пылью, горючими пластмассами может произойти их самовоспламенение в результате выделения теплоты при быстром сжатии кислорода, трении и ударе твердых частиц о металл, а также электростатического искрового разряда. Поэтому при использовании кислорода необходимо тщательно следить за тем, чтобы он не находился в контакте с легковоспламеняющимися и горючими веществами.
Всю кислородную аппаратуру, кислородопроводы и баллоны необходимо тщательно обезжиривать. способен образовывать в широких пределах взрывчатые смеси с горючими газами или парами жидких горючих, что также может привести к взрывам при наличии открытого огня или даже искры.
Отмеченные особенности кислорода следует всегда иметь в виду при использовании его в процессах газопламенной обработки.
Атмосферный воздух в основном представляет собой механическую смесь трех газов при следующем их объемном содержании: азота - 78,08%, кислорода - 20,95%, аргона-0,94%, остальное - углекислый газ, закись азота и др. Кислород получают разделением воздуха на кислород и методом глубокого охлаждения (сжижения), попутно идет отделение аргона, применение которого при непрерывно возрастает. Азот применяют как защитный газ при сварке меди.
Кислород можно получать химическим способом или электролизом воды. Химические способы малопроизводительны и неэкономичны. При электролизе воды постоянным током кислород получают как побочный продукт при производстве чистого водорода.
В промышленности кислород получают из атмосферного воздуха методом глубокого охлаждения и ректификации. В установках для получения кислорода и азота из воздуха последний очищают от вредных примесей, сжимают в компрессоре до соответствующего давления холодильного цикла 0,6-20 МПа и охлаждают в теплообменниках до температуры сжижения, разница в температурах сжижения кислорода и азота составляет 13°С, что достаточно для их полного разделения в жидкой фазе.
Жидкий чистый кислород накапливается в воздухоразделительном аппарате, испаряется и собирается в газгольдере, откуда компрессором его накачивают в баллоны под давлением до 20 МПа.
Технический кислород транспортируют также по трубопроводу. Давление кислорода, транспортируемого по трубопроводу, должно быть согласовано между изготовителем и потребителем. К месту кислород доставляется в кислородных баллонах, и в жидком виде - в специальных сосудах с хорошей теплоизоляцией.
Для превращения жидкого кислорода в газ используют газификаторы или насосы с испарителями для жидкого кислорода. При нормальном атмосферном давлении и температуре 20°С 1 дм 3 жидкого кислорода при испарении дает 860 дм 3 газообразного. Поэтому доставлять кислород к месту сварки целесообразно в жидком состоянии, так как при этом в 10 раз уменьшается масса тары, что позволяет экономить металл на изготовление баллонов, уменьшать расходы на транспортировку и хранение баллонов.
Для сварки и резки по -78 технический кислород выпускается трех сортов:
- 1-й - чистотой не менее 99,7%
- 2-й - не менее 99,5%
- 3-й - не менее 99,2% по объему
Чистота кислорода имеет большое значение для кислородной резки. Чем меньше содержится в нем газовых примесей, тем выше скорость реза, чище и меньше расход кислорода.
Практическая работа №4 7 класс.
Получение кислорода из пероксида водорода и доказательство его наличия .
Цель: 1) познакомиться со способом получения кислорода в лаборатории и его химическим свойством - поддерживать горение;
2) научиться собирать газ в сосуд вытеснением воздуха;
3) совершенствовать умение работать с простейшими приборами.
С техникой безопасности знаком (а)________________________________
План:
1. Налейте в стакан по 8-15 мл раствора пероксида водорода.
2.Добавьте в стакан (на кончике шпателя) оксид марганца (IV). Что наблюдаете?
3. Проверяем наличие кислорода тлеющей лучинкой.
4.Лучинку не макните в пероксид водорода.
5. Напишите уравнение реакции.
2 H 2 O 2 = 2 H 2 O + O 2
Пошла бурная реакция между пероксидом водорода и оксидом марганца (IV).
Тлеющая лучинка загорелась ярким пламенем.
Второй способ получения кислорода.
Получение кислорода из перманганата калия(марганцовки) и гидроперита
Получение кислорода из ... - Youtube.com
youtube
.
com
/
watch
?
v
=-
kem
8
rOavEo
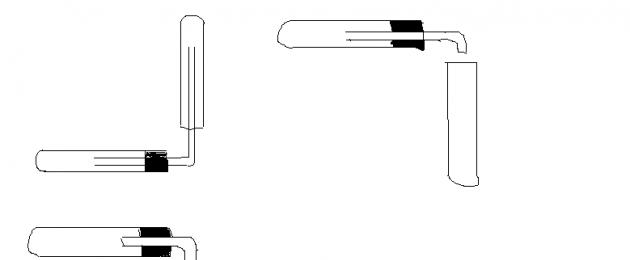
В основание пробирки, в которой находится перманганат калия поместить комочек ваты и закрыть пробирку газоотводной трубкой.
Закрепить пробирку держателем. Опустить конец газоотводной трубки в пустую пробирку.
Нагреть пробирку с перманганатом калия, соблюдая правила нагревания.
Соберите кислород в пробирку способом вытеснения воздуха. Проверьте его наличие с помощью тлеющей лучинки. Прекратите нагревание.
оформите отчет о работе: а) зарисуйте прибор для сбора кислорода, сделайте соответствующие подписи; б) заполните таблицу, дописав предложения и закончив уравнения реакций.
KMnO 4 K 2 MnO 4 + … + …
2. Нагревание пробирки с перманганатом калия и собирание кислорода методом вытеснения воздуха
В пробирке происходит…
Пробирку для сбора кислорода следует держать … дном, потому что…
3. Доказательство наличия кислорода в пробирке с помощью тлеющей лучинки
Тлеющая лучинка…
Кислород поддерживает …
ВЫВОД . Один из способов получения кислорода в лаборатории – разложение КMnO 4 . Кислород – газ без цвета и запаха, тяжелее воздуха в 1,103 раза (M r (O 2) = 32, M r (возд.) = 29, из чего следует 32/29 1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды. Приведите рабочее место в порядок. Сдайте тетради на проверку.
Подумайте и ответьте:
Кислород в лаборатории получают при нагревании перманганата калия. Полученный газ можно собрать путем вытеснения воздуха, используя прибор;

Какую посуду надо использовать при работе?
А) чистую Б) грязную В) с трещинами Г) какая есть, ту и использовать
Пробирку нагревают
А) в верхней части пламени Б) в нижней части пламени В) не имеет значения
Спиртовку тушат
А) задувая огонь Б) колпачком В) руками
Почему нельзя пользоваться грязной посудой?
А) неприятно брать в руки Б) можно получить неточный результат
О оздух не является химическим соединением отдельных газов. Теперь известно, что он представляет собою смесь из азота, кислорода и так называемых редких газов: аргона, неона, криптона, ксенона и гелия. Кроме того, воздух содержит ничтожные количества водорода и углекислого газа.
Главная составная часть воздуха - азот. Он занимает больше 3Д всего объёма воздуха. Пятую часть воздуха составляет «огненный воздух» - кислород. А на долю остальных газов приходится около одной сотой части.
Каким же образом удаётся разделить эти газы и получить из воздуха чистый кислород?
30 лет назад сравнительно широко применялся химический способ получения кислорода. Для этого использовалось соединение металла бария с кислородом - оки-сь бария. Это вещество имеет одно интересное свойство. Нагретая до тёмнокрасного цвета (примерно до 540 градусов) окись бария энергично соединяется с кислородом воздуха, образуя при этом новое более богатое кислородом вещество - перекись бария. Однако при дальнейшем нагревании перекись бария разлагается, выделяет кислород и снова превращается в окись. Кислород при
Этом улавливается и собирается в особые сосуды - баллоны, а перекись бария охлаждается до 540 градусов, чтобы снова получить способность извлекать кислород из воздуха.
Кислородные установки, работавшие по такому способу, давали несколько кубических метров газа в час. Однако они были дороги, громоздки и неудобны. Кроме того, окись бария при работе постепенно теряла свои поглотительные свойства и её приходилось часто менять.
Всё это привело к тому, что с течением времени химический способ получения кислорода из воздуха был вытеснен другими, более совершенными.
Наиболее просто удаётся выделить кислород из воздуха в том случае, если воздух предварительно превращён в жидкость.
Жидкий воздух при обычном атмосферном давлении имеет крайне низкую температуру-минус 192 градуса, то-есть на 192 градуса ниже точки замерзания воды. Но температура ожижения отдельных газов, входящих в состав воздуха, не одинакова. Жидкий азот, например, кипит и испаряется при температуре минус 196 градусов, а кислород при минус 183 градуса. Эта разница в 13 градусов и позволяет разделить жидкий воздух на составляющие его газы.
Если налить жидкий воздух в какой-либо сосуд, он энергично закипит и очень быстро испарится. При этом в первые моменты испаряется преимущественно азот, и жидкий воздух всё больше обогащается кислородом. Этот процесс и положен в основу устройства специальных аппаратов, применяющихся для разделения воздуха.
В настоящее время жидкий воздух широко используют для промышленного получения кислорода. Однако, чтобы превратить атмосферный воздух в жидкое состояние, его нужно охладить до весьма низкой температуры. Поэтому современный метод получения жидкого воздуха называется методом глубого охлаждения.
Глубокое охлаждение воздуха ведут в специальных машинах. Но, прежде чем рассказать об их работе, нам необходимо познакомиться с несколькими простейшими физическими явлениями.
П Омечтаем немного о будущем... 195... год. Наш автомобиль мчится по сверкающему асфальту загородного шоссе. По сторонам, в тени деревьев, мелькают красивые жилые здания. Машина быстро влетает на пригорок, и …
В этой книге мы могли остановиться лишь на отдельных примерах практического использования кислорода. На самом деле область применения «огненного воздуха» значительно шире. Одной из важнейших задач техники наших дней является …
К Ислород активно поддерживает горение. Значит, его целесообразно применять прежде всего в тех процессах, которые связаны с горением, с получением высоких температур. Таким процессом, помимо газификации твёрдых топлив, является производство …